A pandemia de COVID-19 trouxe para os holofotes os muitos modelos usados pelos cientistas para melhor entender a doença e tentar prever seus rumos, levantando informações fundamentais para embasar estratégias na luta global contra o novo coronavírus. Os modelos são muitos e variados, mas também têm muito em comum, em especial a aplicação de ferramentas matemáticas e estatísticas e a forte dependência da acurácia -- isto é, da capacidade de refletir a realidade -- dos dados que os alimentam.
Dados ruins ou insuficientes, metodologias falhas ou mal trabalhadas geram modelos magros e frágeis, incapazes de guiar decisões ou indicar medidas eficazes no combate ao SARS-CoV-2. Já modelos robustos, sustentados pelos dados mais confiáveis e atualizados, integrados na estrutura lógica mais completa e fiel à realidade possível, podem ajudar, em muito, a controlar a pandemia e evitar milhões de mortes.
Modelos de projeção
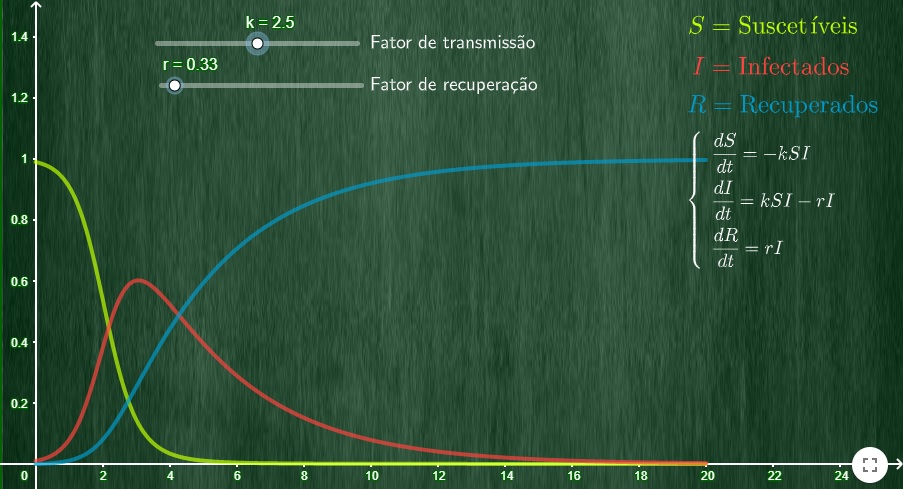
Desde o início da pandemia, um dos tipos de modelo mais usados pelos epidemiologistas e divulgados para o público é o que busca prever a disseminação do vírus na população. Baseado em um sistema concebido, ainda nos anos 1920, pelos pesquisadores escoceses Anderson Gray McKendrick e William Ogilvy Kermack, na esteira da pandemia da gripe espanhola que causara dezenas de milhões de mortes no fim da década anterior, ele tem uma estrutura compartimentalizada, em que as pessoas estão distribuídas de acordo com seu “estado” com relação à doença em grupos interconectados que trocam indivíduos.
Originalmente, as pessoas nestes modelos epidemiológicos eram divididas em três categorias básicas: “suscetíveis” (S); “infectadas” (I); e “recuperadas” (R), classificação que paradoxalmente inclui tanto as curadas quanto as mortas. Posteriormente, foram acrescidos outros dois grupos: “expostas” (E), para melhor modelar o comportamento de doenças não imediatamente infectantes ou infecciosas, isto é, que têm um período de incubação em que não são necessariamente sintomáticas e/ou transmissíveis; e de “imunidade cruzada” (C), para abarcar casos de doenças que sofrem mutações e nos quais indivíduos expostos, infectados e depois curados obtêm imunidade temporária, para depois voltarem a ficar suscetíveis a uma variante da doença original, como ocorre com a gripe sazonal, provocada pelos vírus Influenza.
Levando em conta informações conhecidas ou presumidas sobre os patógenos (agentes causadores de doenças, que podem ser um vírus, bactéria, parasita, por exemplo), a taxa de reprodução básica (quantidade de pessoas que um infectado em média contagia “naturalmente”, conhecida como R0), tempo de recuperação dos pacientes, mortalidade, etc.; e sobre o comportamento da população – como a densidade demográfica, a taxa de contato social – as equações destes modelos podem, então, ajudar a prever como a doença deverá se propagar pela população.
Se uma doença tem R0 abaixo de 1, sua transmissão minguará e ela eventualmente vai desaparecer de uma população. Se R0 for igual a 1, ela se tornará endêmica. Já se o R0 for maior que 1, a doença vai disseminar cada vez mais rápido entre as pessoas, tornando-se epidêmica. No caso do SARS-CoV-2, os estudos apontam que tem um R0 entre 2 e 3, mas podendo chegar a mais de 5 e até quase 9. Em comparação, a gripe sazonal tem R0 estimado em cerca de 1,3, enquanto o vírus influenza que causou a pandemia de gripe espanhola de 1918-1919 teve o R0 calculado entre 1,4 e 2,8.
Quando os cientistas montaram os primeiros modelos da COVID-19, acenderam o sinal de alerta. As projeções eram de uma propagação acelerada da doença, com o número de doentes aumentando de forma exponencial num curto período. Acrescentando a isso as taxas de hospitalizações e mortes observadas em sua origem, a cidade de Wuhan, na província de Hubei, na China, o alarme soou ainda mais alto.
Ou se tentava conter a disseminação, diminuindo a taxa efetiva de reprodução dos vírus (Re) para menos que a “natural”, e preferencialmente para abaixo de 1, ou veríamos um colapso dos sistemas de saúde, incapazes de atender tantos doentes, muitos deles graves, ao mesmo tempo. Diante disso, vários governos ainda hesitaram – o Reino Unido chegou a cogitar um isolamento social apenas de pessoas dos grupos considerados de maior risco de agravamento da doença, como idosos e portadores de doenças crônicas, deixando os mais jovens livres para circular e se infectar, na esperança de alcançar logo a chamada imunidade de rebanho -, mas, sem alternativas como vacinas ou tratamentos, acabaram por impor medidas restritivas, como fechamento de escolas e comércio, estratégias de distanciamento social e, mais recentemente, uso obrigatório de máscaras.
Os modelos compartimentais do tipo SIR, no entanto, não ajudam só a prever a dinâmica futura de uma epidemia, indicando quando e qual pode ser seu pico, para chegar, com o mínimo de perda de vidas possível, à esperada imunidade de rebanho, no agora proverbial processo de “achatamento da curva” de contaminação. Ajustando as curvas aos dados observados no início da fase de crescimento exponencial, como o número de casos, hospitalizações e mortes, eles também permitem apurar de forma reversa informações importantes sobre as doenças, como sua taxa de reprodução efetiva numa população em um determinado período, e a eficácia das medidas de contenção em reduzi-la, indicando se devem ser reforçadas ou já podem ser afrouxadas.
Análise reversa de dados
Cálculos reversos a partir da análise de dados observados estão no cerne de outros modelos muito úteis no combate à COVID-19 e outras doenças. Mas, no lugar de tentar prever o que vai acontecer, estes estudos têm como objetivo fazer um retrato da situação em determinado momento, preenchendo as lacunas na vigilância sanitária e monitoramento da pandemia.
É com modelos assim que diversos grupos de pesquisa, no Brasil e no mundo, buscam dar a real dimensão da pandemia, revelando fenômenos como subnotificação de casos. Tendo como base os números oficiais, e juntando a eles observações prévias sobre a doença, como taxas de mortalidade e hospitalização para diferentes faixas etárias da população, os cientistas conseguem estimar quantas pessoas já podem ter sido, de fato, atingidas pelo vírus e permanecido assintomáticas, sofrido sintomas leves da doença ou morrido sem registro, migrando do grupo dos suscetíveis para o de recuperados.
Assim, estes estudos também fornecem informações sobre a eficácia das medidas de contenção e onde cada população está no caminho para a imunidade de rebanho. Conjugados às previsões dos modelos SIR, eles também deverão ser usados para guiar a saída das restrições, bem como monitorar a situação para sua eventual reimposição parcial ou total, de forma a prevenir uma nova explosão de casos e evitar uma segunda onda de crescimento exponencial.
Entre os principais grupos que estão unindo modelos preditivos do tipo SIR com cálculos reversos e análise de dados para fazer projeções e construir cenários gerais periódicos da pandemia estão o portal COVID-19 Brasil e o liderado por pesquisadores do Centro MRC de Análise de Doenças Infecciosas Globais do Imperial College de Londres. Para o Brasil, por exemplo, levantamentos recentes de ambos apontam que os casos confirmados da doença representam apenas entre pouco mais de 7% a cerca de 11% do total real, o que significa que registramos só um a cada 13 ou cerca de 1 a cada 10 infectados, respectivamente.
Estudos retrospectivos
Os cálculos reversos, porém, não são a única maneira de detectar subnotificação de casos e mortes. Outro método para isso são os chamados estudos retrospectivos, que comparam dados históricos e séries temporais com as informações atuais na busca por anomalias que indiquem discrepâncias nos números oficiais.
Exemplo disso é estudo recente de pesquisadores das universidades federais de Minas Gerais (UFMG) e de Ouro Preto (UFOP), já divulgado aqui mesmo na Revista Questão de Ciência, que com base em de internações hospitalares causadas por síndromes respiratórias agudas semelhantes à COVID-19 de 2012 a 2019 aponta que os números de casos e mortes podem ser 7,7 maiores que os oficialmente registrados.
Mas a força e utilidade dos estudos retrospectivos vai muito além disso. Com eles também é possível tentar recriar o caminho da COVID-19, e assim detectar falhas no sistema de vigilância sanitária que podem, e devem, ser sanadas não só para diminuir o risco de que a epidemia fuja do controle após o relaxamento das medidas restritivas como para evitar tragédia humana e econômica similar, ou ainda maior, em uma futura pandemia, que não é questão de se, mas de quando, e que pode ter como agente um patógeno mais mortal que o SARS-CoV-2.
É o caso, por exemplo, de pesquisa publicada esta semana pela Fiocruz sobre a chamada “disseminação oculta” do novo coronavírus pelo Brasil e alguns países da Europa e Américas. De acordo com este estudo, o SARS-CoV-2 já de espalhava pelo Brasil ainda na primeira semana de fevereiro, mais de 20 dias antes do diagnóstico do primeiro caso no país, em 26 de fevereiro, e quase 40 dias antes da confirmação oficial de que já havia transmissão comunitária do vírus em território brasileiro, em 13 de março.
“Esse período bastante longo de transmissão comunitária oculta chama a atenção para o grande desafio de rastrear a disseminação do novo coronavírus e indica que as medidas de controle devem ser adotadas, pelo menos, assim que os primeiros casos importados forem detectados em uma nova região geográfica”, diz Gonzalo Bello, pesquisador do Laboratório de Aids e Imunologia Molecular do IOC/Fiocruz e coordenador do estudo, em comunicado da Fiocruz. “A intensa vigilância virológica é essencial para detectar precocemente a possível reemergência do vírus, informando os sistemas de rastreamento de contatos e fornecendo evidências para realizar as medidas de controle apropriadas”, complementa.
Cesar Baima é jornalista científico e editor-assistente da Revista Questão de Ciência
